

长生生物拖累疫苗股重挫 华北制药为何一字涨停?
长生生物“问题疫苗”还在持续发酵之际,华北制药却收到国家食品药品监督管理总局发来的“大红包”。
拿到这张批文 股价一字涨停
7月23日晚间华北制药发布公告称,2018年7月20日,华北制药股份有限公司(以下简称“公司”)收到下属子公司华北制药集团新药研究开发有限责任公司(以下简称“新药公司”)的通知,其自主研发的一类新药重组人源抗狂犬病毒单抗注射液(200IU/瓶,500IU/瓶)(以下简称“该项目”)III期临床试验申请获国家食品药品监督管理总局(以下简称“国家食药监局”)核准签发的《药物临床试验批件》。

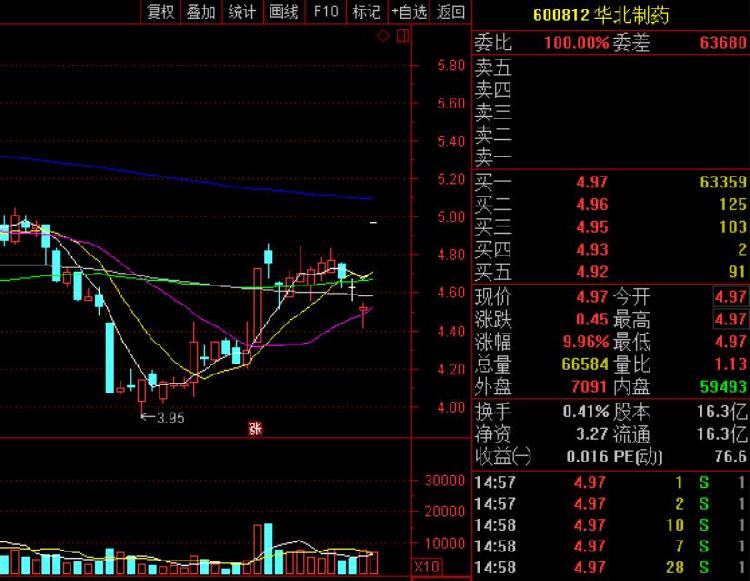
二级市场上,这一重磅消息直接刺激华北制药周二一字封板,上涨9.96%,成交3309万元,换手0.41%。目前A股市场受到“问题疫苗”波及的疫苗股最近大跌,主角长生生物收获7个一字跌停板,阶段跌幅达52.14%,康泰生物连续2跌停。
据公告称,重组人源抗狂犬病毒单抗注射液是新药公司自主创新项目,被列为国家“重大新药创制”科技重大专项品种。其作用机制及适应症为将本品与狂犬疫苗联用,用以补充狂犬疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动免疫作用,用于被狂犬或其它狂犬病毒易感动物咬伤、抓伤患者的被动免疫。目前,新药公司该产品已完成Ⅰ、Ⅱ期临床试验,Ⅲ期临床试验已获《药物临床试验批件》。
研发投入金额7401.87万元
2007年6月28日新药公司首次提交临床试验申请(200IU/瓶,500 IU/瓶两个规格),并于2009年6月25日获得临床试验批件(批件号为2009L06541 和 2009L06542)。
该项目Ⅰ期临床试验于2013年10月完成。Ⅰ期临床试验是首次人体试验,在健康成人受试者中考察产品单用或与狂犬病疫苗联用的剂量耐受性和安全性,考察产品的药代动力学和抗体中和活性,试验结果显示,重组人源抗狂犬病毒单抗注射液耐受性良好,药物在人体的安全性得到了初步确证。
该项目Ⅱ期临床试验于2018年4月完成。Ⅱ期临床试验为随机、盲法、平行对照试验,在健康成年受试者中比较重组人源抗狂犬病毒单抗注射液(rhRIG)联合人用狂犬病疫苗(Vero 细胞)与狂犬病人免疫球蛋白(HRIG)联合人用狂犬病疫苗(Vero 细胞)模拟狂犬病暴露后治疗的安全性和中和抗体活性。试验结果显示,rhRIG 与疫苗联用起效更快,中和作用更高,整体保护效力优于 HRIG 与疫苗联用;受试者总体耐受性好,无因不良反应而退出试验的受试者。
截至目前,该项目累计研发投入金额为7401.87万元。根据《药品注册管理办法》的相关规定,药物在获得 III 期临床试验批件后,需开展临床试验并经国家药监局审评、审批,申报生产并获得新药证书和生产批件后方可生产上市。
国内尚无该类药物上市销售
国内尚无重组抗狂犬病毒单抗药物上市销售。国内可用于狂犬病毒暴露后预防的被动免疫制剂为抗狂犬病血清和狂犬病人免疫球蛋白。通过CFDA 网站数据查询结果显示,截至当前国内有 17 家企业具有狂犬病人免疫球蛋白批准文号,未批准进口产品销售。根据中检院年度批签发报告数据,2015-2017 年批签发狂犬病人免疫球蛋白分别为394.4万瓶、338.3万瓶、509.6 万瓶(折合 200IU)。
印度血清研究所研发的重组抗狂犬病毒单抗注射液已于2016年12月在印度批准上市;荷兰 Crucell 公司和印度 Zydus 研究中心已完成Ⅱ期临床。公司未从公开渠道查询到上述公司关于该产品的Ⅱ、Ⅲ临床试验数据及市场销售数据。
华北制药是我国最大的化学制药企业之一,主要产品涵盖抗感染药物(原料药、中间体及其制剂)、生物技术药物、心脑血管及免疫调节剂等新治疗领域药物、维生素及营养保健品、生物农兽药等五大板块近700余个品规。公司2018年上半年净利润预增100%。
上游新闻记者 王光建

