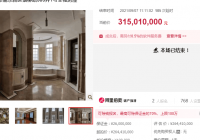
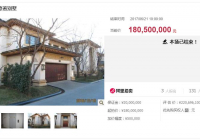
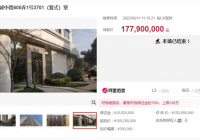
3月21日,上游新闻记者从重庆市药监局获悉,该局近日发布关于实施医疗器械注册与生产许可并联审批工作机制(试行)的通知,宣布自即日起在重庆试行。
所谓并联审批,即注册和生产许可同步进行。它可以更好整合行政审批流程,提高行政审批效能。
根据医疗器械注册与生产许可并联审批工作机制(试行),符合以下情形的,相关联的第二类医疗器械产品注册与生产许可实行并联审批。包括第二类医疗器械首次注册和《医疗器械生产许可证》核发或变更,第二类医疗器械变更注册和《医疗器械生产许可证》变更,以及市药监局认为可以并联审批的其他情形。
值得注意的是,第二类医疗器械注册人委托生产的,不纳入医疗器械注册与生产许可并联审批范围。
据悉,在准予注册与生产许可的同时,行政审批服务中心应将医疗器械注册与生产许可并联审批信息,通过重庆市药品智慧监管平台推送至器械监管处、检查局用于事中事后监管。
市药监局有关负责人表示,将加强并联审批企业的监督管理,企业逾期未整改到位的,检查局应对其采取约谈、告诫、责令整改等措施,涉嫌违法违规的,应依法予以处理;审批处应将相应企业记录在册,不支持其再次申请并联审批。
上游新闻记者 陈瑜
【免责声明】上游新闻客户端未标有“来源:上游新闻”或“上游新闻LOGO、水印的文字、图片、音频视”等稿件均为转载稿。如转载稿涉及版权等问题,请联系上游。